Vědci z Centra regionu Haná pro biotechnologický a zemědělský výzkum (CRH) spolu s kolegy z Itálie, Finska a Nizozemska popsali zásadní roli proteinu Lhcb9 pro fungování mechů. Podle nich právě tento protein typický pro mechy umožňuje rostlinám zajistit si světlo potřebné pro fotosyntézu i ve stinných lesních porostech. Unikátní zjištění zveřejnil prestižní časopis Nature Plants.
Vědci se u mechu čepenka odstálá (Physcomitrella patens) zabývali strukturou fotosystému 1, který patří k důležitým funkčním jednotkám fotosyntetického aparátu rostlin. Čepenka je modelový organismus pro studium evoluce, vývoje a fyziologie rostlin. Tento jen několik milimetrů vysoký mech představuje evoluční přechod mezi nižšími a vyššími rostlinami.
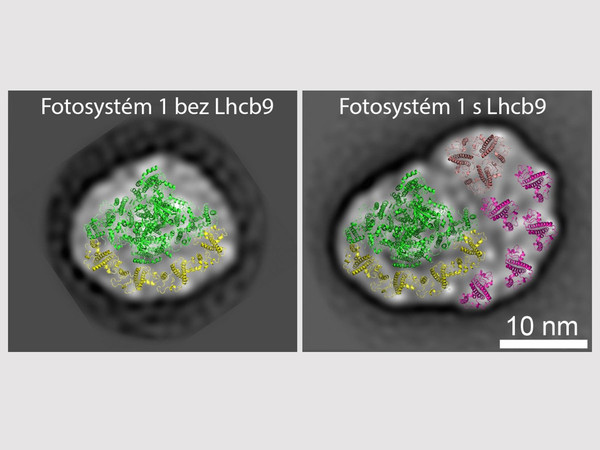
„Cílem našeho projektu bylo popsat strukturu fotosystému 1 izolovaného z mechu a zjistit, jakým způsobem tuto strukturu ovlivňuje přítomnost či absence proteinu Lhcb9. Jedná se o tzv. anténní protein, který dovede absorbovat světlo. Jeho unikátnost spočívá v tom, že je strukturně podobný anténním proteinům, které se obvykle váží na fotosystém 2. Obsahuje však i speciální chlorofyly, které dokáží absorbovat světlo ve vzdálené červené oblasti spektra, což je zase vlastnost anténních proteinů fotosystému 1. Protein Lhcb9 tak v sobě tyto vlastnosti kombinuje,“ uvedl biofyzik z CRH Roman Kouřil.
Výzkumníci v Olomouci zkoumali fotosystém 1 izolovaný z divokého typu mechu a výsledky porovnávali s mutantní rostlinou, která protein Lhcb9 postrádala. Pro izolaci využili speciální metodu bezbarvé nativní polyakrylamidové elektroforézy, která umožňuje šetrnou separaci nestabilních fotosyntetických komplexů bez jejich poškození. „Tuto metodu jsme v Olomouci v minulosti optimalizovali a s jejím využitím máme bohaté zkušenosti. To byl jeden z bonusů, který jsme do společného výzkumu přinesli,“ uvedl další z autorů studie Lukáš Nosek.
Velmi dobrých výsledků dosahují olomoučtí biofyzici i v samotném zkoumání struktur separovaných proteinových komplexů pomocí elektronové mikroskopie. „Porovnáním struktur fotosystému 1 u jednotlivých vzorků jsme mohli říci, jaký dopad má na jeho strukturu přítomnost či absence proteinu Lhcb9. Zjistili jsme, že jeho přítomnost je velice důležitá pro to, aby fotosystém 1 byl schopen navázat více anténních proteinů a absorbovat tak více světla dlouhých vlnových délek. To je zcela zásadní pro adaptaci mechů na jejich přirozené prostředí, v němž jsou právě na tento druh světla odkázány,“ vysvětlil Kouřil.
Pro odborný svět byla informace o významu proteinu Lhcb9 i struktuře fotosyntetického systému 1 v Physcomitrelle zcela nová. Očekávalo se totiž, že mechy vůbec nemají chlorofyly schopné absorbovat světlo dlouhých vlnových délek. Nyní je však zřejmé, že tuto funkci plní protein Lhcb9, který navíc umožňuje vazbu dalších anténních proteinů, jež zvyšují absorpci světla. Podle biofyziků mohla studie vzniknout jen díky dlouhodobé spolupráci předních evropských laboratoří, která přinesla i v minulosti několik převratných výsledků a publikace v nejprestižnějších časopisech. Vzájemná spolupráce je v současné době ještě více posílena díky společnému evropskému projektu SE2B (Horizon 2020: MSCA –INT), v rámci kterého se projektu účastnil i postgraduální student biofyziky Rameez Arshad. Na nynější strukturální studii by v budoucnu mohly navázat další funkční výzkumy.
„Podařilo se nám ukázat, že přítomnost proteinu Lhcb9 umožňuje tvorbu většího anténního komplexu. Dosud ale nevíme, kde přesně se v rámci tohoto velkého komplexu protein Lhcb9 nachází. Do budoucna by tedy bylo zajímavé jeho pozici jednoznačně určit. K tomu by nám mohla pomoci metoda 3D kryogenní elektronové mikroskopie, která umožňuje studium proteinových komplexů s téměř atomárním rozlišením. Je to ostatně směr, kterým bychom se chtěli v budoucnu ubírat,“ uzavřel Kouřil.