Mezinárodní tým vědců, mezi nimiž nechyběli ani zástupci Regionálního centra pokročilých technologií a materiálů Přírodovědecké fakulty UP a Biofyzikálního ústavu Akademie věd ČR, dospěl k unikátním zjištěním o HuR (Human antigen R) bílkovině, jejíž zvýšené množství bylo detekováno u řady nemocí. Výsledky výzkumu by mohly přispět k vytváření nových léčebných postupů, ale přinášejí i obecné informace o interakci těchto specifických bílkovin s RNA.
Práci pod názvem Molecular basis for AU-rich element recognition and dimerization by the HuR C-terminal RRM nedávno publikoval časopis Proceedings of the National Academy of Sciences (PNAS).
Interakce mezi bílkovinami (proteiny) a RNA je důležitým molekulárním procesem, který stojí v pozadí evoluce od světa prvních živých molekul RNA až k dnešním organismům. V současných biologických systémech, snad jen s výjimkou nejjednodušších viroidů, všechny funkční molekuly RNA během své existence neustále interagují proteiny. Živé buňky dokonce v případě, že ve svém nitru objeví osamocenou molekulu RNA, zareagují jejím okamžitým zničením. Jedná se o pradávnou evoluční obranu před doslova všudypřítomnými RNA viry.
Aby buňky neničily vlastní molekuly RNA a zároveň je byly schopny regulovat, přišla evoluce se širokou paletou proteinů specializovaných přímo na interakci s RNA. Jedním z nich je RRM (RNA Recognition Motif – motiv rozpoznávající RNA) doména. Obecně platí, že vazba RRM domény na RNA je velmi specifická a protein je díky ní schopný velmi přesně vyhledat konkrétní RNA sekvenci. Tyto domény zajišťují ve vyšších organismech plnou polovinu všech protein/RNA interakcí.
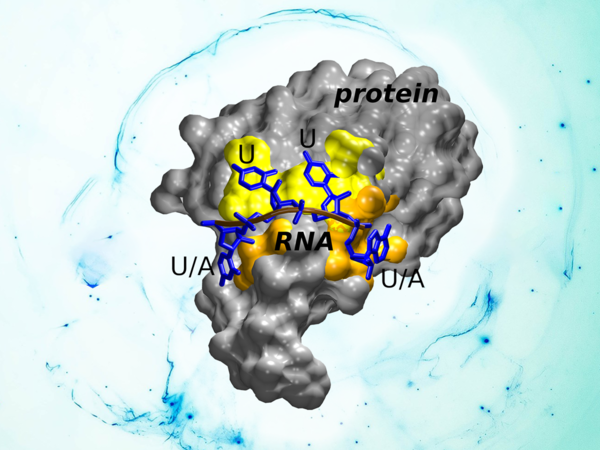
„V našem projektu jsme se věnovali studiu HuR proteinu, který hraje klíčovou úlohu v regulaci mRNA sekvencí bohatých na adenin a uracil (tzv. AU-sekvence). HuR obsahuje hned tři RRM domény přičemž struktura a funkce třetí z nich nebyla známa. Pomocí rentgenové krystalografie se nedávno našim spoluautorům z ETH Curych a farmaceutické společnosti Novartis podařilo získat atomární model třetí RRM domény HuR ve vazbě s RNA,“ uvedl jeden z autorů Jiří Šponer z Biofyzikálního ústavu AV ČR a RCPTM. Podle něj struktura ukázala, že i u navázané RNA dochází k velkému pohybu, což mimo jiné znemožňovalo přesné určení polohy některých nukleotidů. „V naší laboratoři jsme použitím počítačových metod pro studium dynamiky molekul následně ukázali, že tato RRM doména je schopna rozeznávat RNA pomocí pohyblivých a neustále se proměňujících interakcí s proteinem. Takové dynamické rozpoznávání RNA je velmi obtížně zjistitelné experimentálními metodami, které zpravidla poskytují statický obrázek dané molekuly a neobsahují informaci o jejím pohybu. Studium vazby na RNA dále ukázalo, že tato RRM doména má schopnost vázat jak AU-sekvence, tak i sekvence obsahující pouze uracil. Jedním z důsledků dynamického rozpoznávání je totiž to, že vybraná vazebná místa na povrchu domény jsou schopna stejně dobře vázat uracil i adenin, zatímco jiná vážou čistě uracil,“ shrnul poznatky další z autorů Miroslav Krepl.
Tato zjištění významně přispívají k poznání biologické role HuR proteinu, jehož zvýšené množství bylo detekováno u řady nemocí. Objasnění unikátního způsobu rozpoznávání a sekvenční specificity jeho třetí RRM domény proto poskytuje možnost vytvářet nové léčebné postupy. „Vzhledem k biologickému významu RRM domén představuje naše práce rovněž i nový obecný mechanismus, jakým můžou tyto všestranné molekuly rozpoznávat RNA. Dynamické rozpoznávání představuje unikátní evoluční odpověď všude tam, kde je třeba specifické interakce s RNA, ale zároveň buňka potřebuje rychle procházet velké množství různých RNA sekvencí. Tento unikátní způsob interakce se velmi liší od dosavadního klasického modelu, v němž dochází k pevné a v podstatě se neměnící nekovalentní vazbě mezi proteinem a RNA,“ uzavřel Šponer.